
Harnblasenkarzinom: Indikation Chemotherapie
 Die breite molekulargenetische Heterogenität des Harnblasenkarzinoms drückt sich in einer großen pathohistologischen Varianz aus. Dies kann zu einer raschen Resistenz gegen die herkömmlichen Chemotherapieschemata führen.
Die breite molekulargenetische Heterogenität des Harnblasenkarzinoms drückt sich in einer großen pathohistologischen Varianz aus. Dies kann zu einer raschen Resistenz gegen die herkömmlichen Chemotherapieschemata führen.
Das Harnblasenkarzinom ist die fünfthäufigste Tumorerkrankung und betrifft Männer drei- bis viermal häufiger als Frauen, deren Tumorstadium bei Erstdiagnose allerdings höher und damit mit einer schlechteren Prognose behaftet ist. Mehr als 70 Prozent aller Blasenkarzinome sind initial oberflächlich, während 30 Prozent muskelinvasiv imponieren und mit einer höheren Metastasierungsrate sowie Mortalität einhergehen. Pathohistologisch handelt es sich um Transitionalzellkarzinome, die in zahlreichen Varianten auftreten können und molekulargenetisch verschiedene Ursprünge aufweisen. Dies wiederum kann in unterschiedlichem Ansprechen auf die gängigen Chemotherapieschemata resultieren.
Muskelinvasives Blasenkarzinom
Das muskelinvasive Blasenkarzinom kann in den organbegrenzten Stadien T1–3 mit einer radikalen Zystoprostatektomie und einer ausgedehnten pelvinen Lymphadenektomie mit einem Fünf-Jahre-Gesamtüberleben mit 50 bis 80 Prozent erfolgreich behandelt werden. Die daraus resultierende hohe Rezidivrate ist vor allem systemischer Natur: die Metastasierungsrate ist höher als die stadienabhängige Lokalrezidivrate (5–16 Prozent).
Die systemische Chemotherapie ist im metastasierten Stadium, aber auch beim lokalen und regional fortgeschrittenen Stadium sowie im neoadjuvanten und adjuvanten Setting indiziert. Ist bereits eine Metastasierung nachweisbar, muss der palliative Charakter dieser Behandlung in zirka 80 Prozent der Fälle akzeptiert werden.
Lediglich knapp ein Fünftel der Patienten erreicht ein Langzeitüberleben über fünf Jahre. Voraussetzung ist ein sehr guter Performancestatus, eine suffiziente Nierenfunktion (GFR >60ml/min) und das Fehlen viszeraler Metastasen.
Erstlinien-Chemotherapieschemata
Methotrexat/Vinblastin/Adriamycin/Cisplatin (MVAC). 1992 wurde von Jagoda et al. das MVAC-Schema entwickelt, das aus Methotrexat 30mg/m2 am Tag 1, 8 und 15 sowie Cisplatin 70mg/m2, Adriamycin (Doxorubicin) 30mg/m2 und Vinblastin 3mg/m2 am Tag 2 besteht. Dies war der Monotherapie mit Cisplatin mit einem Gesamtüberleben von 12,8 Monaten überlegen. Die besten Ansprechraten wurden bei Lymphknotenmetastasen und lokalen Rezidiven nach Zystektomie beobachtet (>60 Prozent). Therapielimitierend war die Hämatotoxizität im Sinne von febrilen Neutropenien (25 Prozent), Thrombopenien (17 Prozent) sowie Polyneuropathien und Stomatitiden (10 Prozent).
2001 intensivierte Sternberg das MVAC-Schema, indem der Therapiezyklus alle zwei anstatt der üblichen vier Wochen wiederholt wurde. Dies resultierte in einer Erhöhung der Dosis von Cisplatin und Doxorubicin um den Faktor 2, die Intensität von Methotrexat und Vinblastin reduzierte sich auf 0,67 und führte damit auch zu einer Reduktion der den beiden Substanzen zugeordneten Nebenwirkungen Mucositis und Polyneuropathie.
Durch die Unterstützung mit G-CSF (Granulozyten- Kolonie-stimulierendem Faktor) wurde die Akzeptanz erhöht, sodass vor allem die Hämatotoxizität niedriger ist als beim klassischen Schema, dies zeigte jedoch keinen signifikanten Überlebensvorteil. Allerdings lag das Gesamtüberleben mit 15,5 Monaten deutlich über dem des Schemas von 1992. Das längere progressionsfreie Überleben von 9,1 Monaten und die höhere Ansprechrate von 62 Prozent waren aber signifikant.
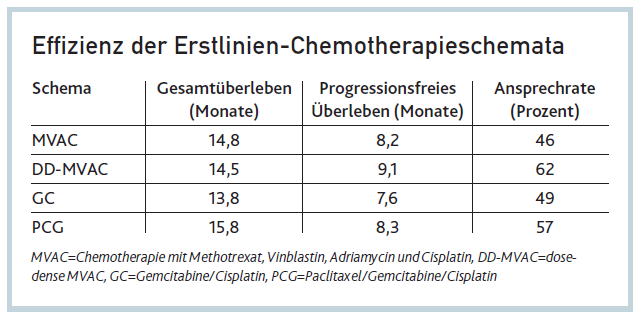
Gemcitabine/Cisplatin (GC). Einige Jahre später konnte Von der Maase eine bessere Verträglichkeit für das konventionell dosierte GC-Schema gegenüber dem ursprünglichen MVAC beweisen. Wegen des besseren proaktiven Nebenwirkungsmanagements konnte GC das Gesamtüberleben von MVAC mit 14,8 Monaten nicht überbieten. Aber besonders die signifikant niedrigere Rate an septischen Komplikationen ließ GC daraufhin zur Standardtherapie avancieren. Das vierwöchige Schema wurde aufgrund der hohen Thrombopenieraten mit konsekutiven Zyklusunterbrechungen und Therapieabbrüchen auf drei Wochen reduziert und die Gemcitabine-Gabe am Tag 15 weggelassen.
Paclitaxel/Gemcitabine/Cisplatin (PCG). 2011 scheiterte die von Bellmunt studierte Zugabe von Paclitaxel zu GC, dieses als Standard abzulösen, weil das geplante Gesamtüberleben von 18 Monaten für den PCG-Arm sehr ambitioniert gewählt wurde. In einer Subgruppenanalyse wurden die für die Signifikanz geforderten vier Monate Überlebensvorteil erreicht, wenn ausschließlich Patienten berücksichtigt wurden, die ihr Primum in der Blase und nicht im oberen Harntrakt hatten.
Ansprech- und Überlebensraten
Die bescheidenen Ergebnisse der Erstlinien-Chemotherapieschemata (siehe Tab.) sind an die Applikation von Cisplatin gebunden. Muss auf Carboplatin oder andere Substanzen ausgewichen werden, reduzieren sich die Ansprech- und Überlebensraten signifikant. So liegt das Gesamtüberleben des von De Santis untersuchten Carbo/Gem-Regimes bei 9,3 Monaten.
Diese Kombination gilt seither bei sogenannten „unfit patients“, die durch reduzierte Kreatinin-Clearance oder eingeschränkten Performance-Status charakterisiert sind, als primäre Option. 20 bis 30 Prozent der Patienten weisen nach Versagen einer Cisplatin-hältigen Erstlinientherapie Prognosefaktoren auf, die sie von einer Zweitlinientherapie mit Vinflunin profitieren lassen mit einen Überlebensvorteil von über zweieinhalb Monaten gegenüber „best supportive care“.
Dabei spielen neben Hämoglobin, das Fehlen von Lebermetastasen sowie ein guter Performance-Status die Hauptrolle.
Neoadjuvantes Setting
Der Einsatz der Chemotherapie im nicht metastasierten Stadium ist für das neoadjuvante Setting am besten untersucht. Die präoperative Applikation erfolgt beim Patienten im guten Allgemeinzustand mit lokal fortgeschrittenen Tumor. Die Rationale für die neoadjuvante Behandlung sind die frühzeitige Therapie einer Mikrometasierung im unbehandelten Patientengut (20–25 Prozent der Fälle) sowie eine pT0-Rate über 30 Prozent nach Zystektomie. Patienten im pT0-Stadium haben die höchsten Überlebensraten.
Eine nahezu 90-prozentige präoperative Applikationsrate, keine wesentlich erhöhte perioperative Morbidität und eine rund 30-prozentige Grad-3/4-Hämatotoxizität machen die Therapie gut verträglich und attraktiv. Die Verzögerung der Zystektomie um rund zwölf Wochen (drei Zyklen zu je drei bis vier Wochen) kann durch die Anwendung von drei bis vier Zyklen des dosisintensiven MVAC- (oder GC-)-Schemas auf die Hälfte reduziert werden.
Adjuvantes Setting
Da die Datenlage für die ebenfalls mögliche adjuvante Chemotherapie bei Hochrisikopatienten nach Zystektomie erheblich schlechter ist und sich auf noch kleinere Kohorten stützt, bleibt sie insbesondere für postoperativ nodalpositive Patienten eine Option. Bei einem vorliegenden exakten histopathologischen Staging werden daher nur jene Patienten behandelt, die ein sehr hohes Progressionsrisiko und eine sehr frühe Metastasierung aufweisen. Eindeutige Überlebensvorteile sind aber durch prospektive Studien bislang nicht belegt.
In der Hälfte der Fälle ist allerdings wegen der vorhandenen Niereninsuffizienz sowie postoperativen Morbiditäten eine zeit- und dosisgerechte Verabreichung des unbedingt erforderlichen Cisplatins unmöglich.
Blasenerhaltende Therapieoptionen
Nach dem optimalen Standardtherapieschema wird bei blasenerhaltenden Optionen, die nach einer möglichst kompletten transurethralen Tumorresektion in der Blase, im Harnleiter oder Nierenbecken eine Radio- und/oder Chemotherapie anschließen, noch immer gesucht. Am häufigsten wird dabei Cisplatin angewendet (Erlanger-Schema). Weitere Substanzen sind der Radiosensitizer Gemcitabine sowie die Kombination 5-FU/Mitomycin C.
Für eine zukünftig erfolgversprechende individualisierte Therapie sind Kenntnisse molekularbiologischer Veränderungen sowie genetischer intratumoraler Mutationen notwendig. Dringend benötigte molekulare Prädiktoren, wie z.B. die Überexpression des ERCC-1-Proteins, könnten das Ansprechen auf bestimmte Therapien vorhersagen.
OA Dr. Franz Stoiber
Abteilung für Urologie und Andrologie
Salzkammergut-Klinikum Vöcklabruck
© MMA, Clinicum Urologie 2014